Il rame nella Tavola Periodica degli Elementi è un elemento chimico che appartiene al gruppo 11 della tavola periodica, con simbolo chimico Cu e numero atomico 29. Si presenta come un metallo rosso-arancio, lucido e facilmente lavorabile.
In questo articolo abbiamo raccolto tutto ciò che devi sapere sul rame, uno dei metalli più versatili e diffusi sulla Terra, con una storia che risale a migliaia di anni fa.
Scorri per leggere la sua posizione nella tavola periodica, le proprietà fisiche e chimiche, e le sue innumerevoli applicazioni pratiche. Dalla sua forma in natura alle leghe più comuni, passando per la sua importanza nell’elettronica e nell’industria.
Rame: cos’è e come appare
Il rame è un metallo di transizione, situato nel gruppo 11 della tavola periodica, con simbolo chimico Cu e numero atomico 29.
Uno dei pochi metalli che si trova in natura in forma quasi pura, il rame si presenta in diverse forme, come pepite di rame nativo o in combinazione con altri minerali, come il solfuro di rame. La sua superficie è di un rosso-arancio brillante che, con il tempo, può sviluppare una caratteristica patina verde, detta “verde rame”, a causa dell’ossidazione.

È un metallo molto malleabile e duttile, il che significa che può essere facilmente modellato e tirato in fili sottilissimi senza rompersi. In termini di durezza, è relativamente morbido rispetto ad altri metalli, ma abbastanza resistente da non deformarsi facilmente.
Caratteristiche generali del rame
Il rame possiede numerose proprietà fisiche e chimiche che lo rendono un metallo unico. Qui elenchiamo le principali, se vuoi approfondirle continua a leggere questo articolo.
- Stato fisico: solido, lucido, di colore rossastro
- Resistenza alla corrosione: buona, si ossida in presenza di aria
- Reattività chimica: moderata, reagisce con alcuni acidi e ossigeno nel tempo
- Conduttività: eccellente conduttore di elettricità e calore
- Malleabilità e duttilità: molto duttile e malleabile, facilmente lavorabile
- Capacità di formare leghe: viene spesso utilizzato in leghe come bronzo e ottone

| Simbolo Chimico | Cu |
| Numero Atomico | 29 |
| Gruppo | 11 (Metalli di transizione) |
| Periodo | 4 |
| Blocco | d |
| Conducibilità Elettrica | Eccellente |
| Colore | Rosso-brunastro (ossidato) |
| Massa Atomica | 63,55 u |
| Densità | 8,96 g/cm³ |
| Punto di Fusione | 1.083 °C |
| Punto di Ebollizione | 2.562 °C |
| Stato Fisico | Solido a temperatura ambiente |
| Resistenza alla Corrosione | Media, suscettibile all’ossidazione e formazione di patina |
| Configurazione Elettronica | [Ar] 3d¹⁰ 4s¹ |
| Elettronegatività | 1,90 (scala di Pauling) |
| Raggio Atomico | 135 pm |
| Energia di Ionizzazione (1ª) | 745,5 kJ/mol |
| Affinità Elettronica | 118,5 kJ/mol |
Il rame nella Tavola Periodica degli Elementi
Il rame occupa la casella 29 nella tavola periodica degli elementi. Appartiene al gruppo 11, come l’oro e l’argento, ed è un metallo di transizione. Il suo numero atomico è 29, il che significa che un atomo di rame contiene 29 protoni nel suo nucleo. Questo lo colloca tra i metalli con una buona conduttività termica ed elettrica, ed è noto per la sua versatilità nelle applicazioni pratiche.
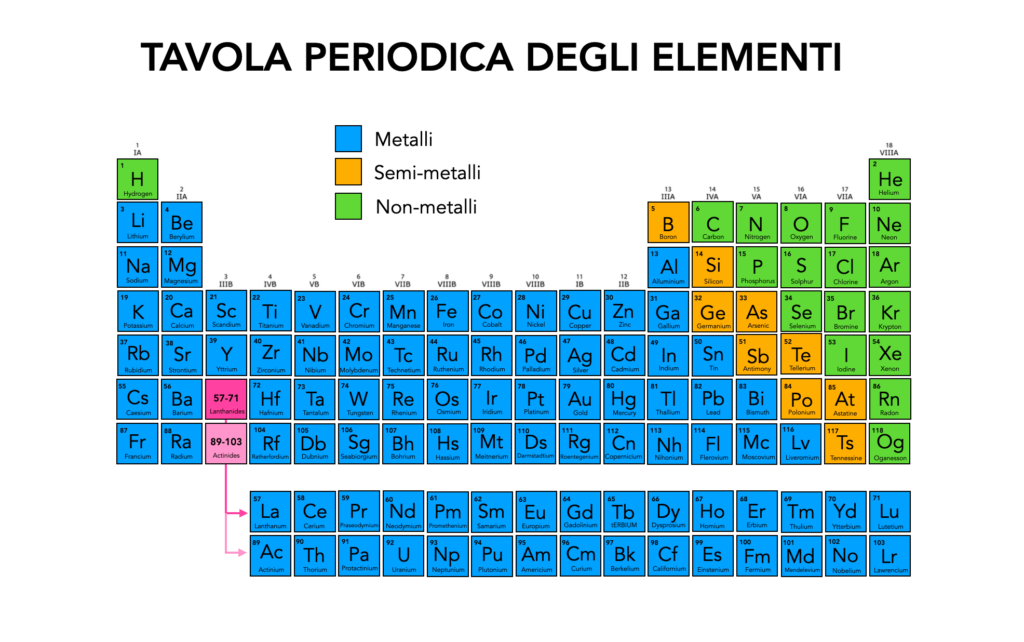
Pur essendo un metallo di transizione, il rame si distingue per la sua reattività chimica relativamente più alta rispetto ad altri metalli della stessa famiglia, come l’oro. Tuttavia, rimane comunque resistente alla corrosione, specialmente quando viene protetto da un sottile strato di ossido che ne impedisce il deterioramento. Grazie a queste proprietà, il rame è ampiamente utilizzato in elettricità, costruzione e nella produzione di leghe come ottone e bronzo.
Rame nella Tavola Periodica: informazioni atomiche e di gruppo
Nel contesto della tavola periodica, il rame offre molte informazioni importanti sulla sua struttura atomica e chimica. Esplorando i dati relativi al rame, vediamo i seguenti dettagli:


- Numero atomico: 29
Il numero atomico del rame è 29, il che significa che ogni atomo di rame possiede 29 protoni nel nucleo e, in uno stato neutro, anche 29 elettroni. Questo numero atomico aiuta a determinare le proprietà chimiche del rame, tra cui la sua disposizione elettronica che gli conferisce la capacità di formare legami metallici e di condurre elettricità.
- Massa atomica: circa 63,5 u
La massa atomica del rame è circa 63,5 unità di massa atomica (u), un valore che rappresenta la media ponderata delle masse degli isotopi naturali del rame. Il suo isotopo più comune è il rame-63, che ha 34 neutroni oltre ai 29 protoni.
- Gruppo: 11
Il rame appartiene al gruppo 11 della tavola periodica, una famiglia che include anche l’oro (Au) e l’argento (Ag). Gli elementi di questo gruppo sono caratterizzati da proprietà chimiche simili, tra cui una conduttività elettrica e termica eccezionali e una buona malleabilità. Questi metalli sono anche noti per la loro capacità di formare leghe forti con altri metalli, come nel caso del bronzo (rame e stagno) e dell’ottone (rame e zinco).
- Periodo: 4
Il rame si trova nel periodo 4 della tavola periodica, il che indica che il suo atomo ha 4 livelli energetici di elettroni. Gli elementi di questo periodo includono metalli come il ferro e il cobalto, ma il rame si distingue per la sua maggiore duttilità e la capacità di formare leghe con vari altri metalli.
- Configurazione elettronica: [Ar] 3d¹⁰ 4s²
La configurazione elettronica del rame è scritta come [Ar] 3d¹⁰ 4s².
In questo caso, [Ar] rappresenta la configurazione elettronica del gas nobile argon, che indica i primi 18 elettroni (1s² 2s² 2p⁶ 3s² 3p⁶). I 10 elettroni nel sottolivello 3d e i 2 nel sottolivello 4s completano la configurazione elettronica del rame. La presenza di un sottolivello 3d parzialmente riempito conferisce al rame una particolare stabilità e lo rende un eccellente conduttore elettrico e termico.
- [Ar] → Rappresenta la configurazione elettronica dell’argon (1s² 2s² 2p⁶ 3s² 3p⁶), che descrive gli elettroni interni dell’atomo fino al livello 18. Questi elettroni non influenzano significativamente le proprietà chimiche del rame, poiché sono più lontani dal nucleo e più stabili.
- 3d¹⁰ → Indica che il sottolivello 3d è completamente riempito con 10 elettroni. Questo conferisce una particolare stabilità all’atomo di rame, contribuendo alle sue eccellenti proprietà conduttive e al suo comportamento chimico.
- 4s² → Indica che ci sono 2 elettroni nel sottolivello 4s. Questi elettroni sono quelli più esterni e sono responsabili della reattività chimica del rame, influenzando il suo comportamento nelle reazioni e nelle leghe che forma con altri metalli.
Posizione del rame nella Tavola Periodica: proprietà derivanti
Il rame si trova nel gruppo 11 della tavola periodica, come l’oro e l’argento. È un metallo di transizione che condivide molte delle proprietà fisiche e chimiche con gli altri metalli del gruppo, tra cui l’elevata conduttività elettrica e termica. Il rame ha 29 protoni nel suo nucleo e 29 elettroni che lo circondano, conferendogli una configurazione elettronica relativamente stabile, che spiega la sua capacità di formare legami metallici forti e una resistenza moderata alla corrosione.
- Metallo del gruppo 11
Gli altri metalli di questo gruppo, come l’argento e l’oro, presentano proprietà fisiche simili al rame, come l’ottima conduttività e la capacità di formare leghe facilmente. Tuttavia, il rame si distingue per la sua grande versatilità nelle applicazioni industriali e per la sua buona resistenza alla corrosione, che lo rende ideale per applicazioni che richiedono una lunga durata nel tempo.
- Posizione nel periodo 4
Il fatto che il rame si trovi nel periodo 4 conferisce al suo atomo una configurazione stabile con orbitali d parzialmente pieni, che sono responsabili delle sue proprietà di conduttività e reattività chimica. Questa posizione nella tavola periodica permette al rame di mantenere la sua stabilità chimica e di non reagire facilmente con l’ossigeno, pur rimanendo reattivo con altri elementi, come nel caso della formazione di ossidi di rame.
Proprietà fisiche del rame
Il rame presenta numerose proprietà fisiche che lo rendono una scelta ideale per molte applicazioni, specialmente in ambito industriale, elettronico e nelle leghe. Di seguito sono elencate le principali caratteristiche fisiche del rame:
- Densità e peso specifico
Il rame ha una densità di 8,92 g/cm³, che lo rende significativamente più pesante rispetto a molti altri metalli come l’alluminio o il ferro. Questa densità è particolarmente vantaggiosa per la realizzazione di componenti che richiedono un buon equilibrio tra peso e resistenza, come cavi e connessioni metalliche.
- Resistenza alla corrosione
Il rame è resistente alla corrosione, anche se non completamente immune. Quando esposto all’aria, forma una patina di ossido di rame che lo protegge dalla continua ossidazione, il che lo rende ideale per utilizzi esterni e in ambienti umidi, come nel caso delle tubature e delle coperture edili.
- Conduttività di calore ed elettricità
Il rame è uno dei migliori conduttori di elettricità e calore. Questa proprietà lo rende il materiale preferito per i cavi elettrici e per molte applicazioni elettroniche avanzate. La sua eccellente conduttività è anche la ragione della sua ampia applicazione nei motori, nelle telecomunicazioni e nei circuiti elettronici.
- Duttilità e malleabilità
Il rame è molto duttile e malleabile, il che significa che può essere facilmente modellato in fogli sottili, fili e tubi senza rompersi. Questa versatilità lo rende fondamentale nell’industria della lavorazione dei metalli e della fabbricazione di gioielli, nonché nelle leghe come l’ottone (rame e zinco) e il bronzo (rame e stagno).
- Punto di fusione relativamente basso
Il punto di fusione del rame è di 1.084°C, che è relativamente basso rispetto ad altri metalli di transizione. Ciò consente una lavorazione più semplice e una maggiore facilità di produzione di fili e altri componenti.
Proprietà chimiche del rame
Il rame è un metallo relativamente stabile, ma possiede alcune proprietà chimiche che lo rendono prezioso anche in numerosi contesti scientifici e industriali.
- Reattività con l’ossigeno
Il rame ha una bassa reattività con l’ossigeno a temperatura ambiente, il che gli consente di mantenere la sua lucentezza. Tuttavia, quando esposto all’aria, reagisce lentamente con l’ossigeno formando una patina di ossido di rame (CuO), che lo protegge dalla corrosione ulteriore. Questa caratteristica lo rende ideale per l’uso in ambienti esterni, come nelle strutture architettoniche e nelle coperture.
- Formazione di leghe
Il rame si lega facilmente con altri metalli, formando leghe che ne modificano le proprietà. Le leghe di rame, come il bronzo e l’ottone, sono molto utilizzate in una vasta gamma di applicazioni. Il bronzo, ad esempio, è apprezzato per la sua resistenza alla corrosione e viene spesso impiegato per monete, sculture e attrezzature industriali.
- Resistenza agli acidi
Il rame è resistente alla maggior parte degli acidi, ma può essere dissolto in acido azotico concentrato, con il quale forma sali come il nitrato di rame. Questa caratteristica è sfruttata in numerosi processi chimici, tra cui la produzione di sali di rame e nell’industria galvanica.
L’atomo del rame
Il rame ha un numero atomico di 29, il che significa che ogni atomo di rame ha 29 protoni nel nucleo e 29 elettroni. La sua posizione nella tavola periodica lo colloca nel gruppo 11, con una configurazione elettronica che ne determina molte delle proprietà chimiche e fisiche.
La disposizione degli elettroni nell’atomo di rame segue il principio di Aufbau. La configurazione elettronica del rame è la seguente:
- K-sottolivello (1° livello): 2 elettroni
- L-sottolivello (2° livello): 8 elettroni
- M-sottolivello (3° livello): 18 elettroni
- N-sottolivello (4° livello): 1 elettrone
La configurazione elettronica completa del rame è quindi 1s² 2s² 2p⁶ 3s² 3p⁶ 3d¹⁰ 4s¹.
Gli elettroni nei sottolivelli 3d¹⁰ e 4s¹ sono particolarmente importanti per le sue proprietà di conduttività e per la formazione di legami metallici.
L’atomo del rame si presenta in natura con una struttura cristallina cuboide a facce centrate (FCC), comune a molti metalli di transizione. In questa configurazione, ogni atomo di rame è circondato da 12 atomi adiacenti, che contribuiscono alle sue ottime proprietà di conduttività e malleabilità. Questa disposizione consente agli atomi di muoversi facilmente l’uno rispetto all’altro, rendendo il rame particolarmente adatto a essere modellato in fili sottili o lamine.
Isotopi del rame
Il nucleo di un atomo di rame contiene 29 protoni e 35 neutroni. La stabilità del rame è legata alla combinazione di questi componenti nel nucleo, che permettono una struttura atomica stabile e facilmente lavorabile.
Il rame ha due isotopi stabili principali: Cu-63 e Cu-65. La presenza di questi isotopi stabili è rilevante non solo per la comprensione della sua massa atomica, ma anche per il comportamento chimico del rame. Il Cu-63 è l’isotopo più abbondante, rappresentando circa il 69% del rame naturale, mentre il Cu-65 è presente nel 31% restante. Gli isotopi del rame non differiscono molto nelle loro proprietà chimiche, ma la loro presenza in natura gioca un ruolo importante nelle applicazioni scientifiche e industriali, dove la precisione nelle misurazioni della massa e della radioattività è cruciale.
Legami atomici
Il rame forma principalmente legami metallici tra i suoi atomi, caratterizzati dalla condivisione di elettroni di valenza che permettono agli atomi di scorrere facilmente gli uni sugli altri.

A volte può formare legami covalenti e ionici con altri elementi. Ad esempio, con l’ossigeno, il rame può formare ossidi di rame, come il CuO (ossido di rame(II)) e Cu₂O (ossido di rame(I)), che sono responsabili della colorazione verde che si osserva quando il rame si ossida. Questi legami chimici sono alla base delle reazioni del rame in ambienti corrosivi e del suo comportamento nelle leghe.

Elettronegatività e reattività chimica
L’elettronegatività è la capacità di un atomo di attrarre a sé gli elettroni di un legame chimico. Maggiore è l’elettronegatività, maggiore è la tendenza dell’atomo a “tirare” gli elettroni verso di sé durante la formazione di un legame.
L’elettronegatività del rame è 1.90 sulla scala di Pauling, il che lo rende meno elettronegativo rispetto ad altri metalli come l’argento (1.93) e l’oro (2.54). Questo significa che il rame tende a formare legami con elementi che sono meno elettronegativi di lui, come nel caso del legame con il ferro nelle leghe di bronzo. Sebbene il rame non sia un metallo altamente reattivo come il sodio o il potassio, può reagire con alcuni acidi e con l’ossigeno in certe condizioni, formando ossidi e sali, ma la sua reattività è molto inferiore rispetto a quella di altri metalli più reattivi come il ferro.
L’energia di ionizzazione è la quantità di energia necessaria per rimuovere un elettrone da un atomo neutro, trasformandolo in un catione. Maggiore è l’energia di ionizzazione, maggiore è la difficoltà con cui un atomo perde un elettrone.
L’energia di ionizzazione del rame è relativamente alta, il che implica che il rame non tende facilmente a perdere elettroni. Questo contribuisce alla sua stabilità chimica, limitando la sua reattività con altri metalli.
L’affinità elettronica è la quantità di energia rilasciata quando un atomo neutro acquisisce un elettrone, formando un anione. Un’atmosfera di affinità elettronica elevata indica una forte tendenza dell’atomo ad accettare un elettrone.
La bassa affinità elettronica indica che il rame non è incline ad acquisire facilmente elettroni, ma preferisce mantenere la sua configurazione stabile.
Origine, storia e curiosità sul rame
Etimologia del termine
Il nome “rame” deriva dal latino aes cyprium, che significa “metallo di Cipro”, poiché nell’antichità l’isola di Cipro era famosa per la sua abbondante produzione di rame. Nel tempo, il termine si è evoluto nel semplice “rame”, che oggi designa il metallo noto per il suo colore caratteristico e le numerose applicazioni.
Storia del rame
La storia del rame è lunga e affascinante, segnando l’inizio della metallurgia e della civiltà umana. Da quando gli esseri umani hanno scoperto come estrarre e lavorare il rame, questo metallo ha avuto un impatto significativo su molteplici aspetti della vita quotidiana e del progresso tecnologico.
Antichità. Il rame è uno dei metalli più antichi utilizzati dall’uomo. La sua lavorazione risale a circa 10.000 anni fa, quando veniva impiegato per la creazione di utensili e armi. Nel corso delle epoche, il rame è stato usato per coniare monete, realizzare ornamenti e oggetti sacri. Già nelle prime civiltà come gli Egizi e i Sumeri, il rame veniva utilizzato per la fabbricazione di gioielli e strumenti quotidiani.
Età del bronzo. Il rame ha avuto un ruolo fondamentale nell’Età del Bronzo, quando veniva fuso insieme allo stagno per formare una lega più durevole: il bronzo. Questo periodo ha segnato una grande innovazione nelle armi e nelle attrezzature, contribuendo allo sviluppo di nuove tecnologie.
Medioevo e Rinascimento. Durante il Medioevo, il rame è stato utilizzato per realizzare monete e come materiale per la costruzione di cupole e tetti di chiese e palazzi, grazie alla sua resistenza alle intemperie. Il Rinascimento ha visto il rame diventare un materiale centrale nelle tecniche di incisione e stampa, nonché in molte applicazioni artistiche.
Età moderna. Con l’avvento dell’industria, il rame ha trovato un impiego sempre maggiore nelle reti elettriche, nelle condutture d’acqua e nell’ingegneria meccanica. La sua capacità di condurre elettricità e la sua resistenza alla corrosione lo hanno reso fondamentale per la nascita e l’espansione delle reti elettriche nel XIX e XX secolo.
Oggi. Oggi, il rame continua a essere un metallo di grande importanza economica e industriale. È utilizzato principalmente nell’industria elettrica, nell’edilizia, e nei trasporti. Inoltre, grazie alle sue proprietà di resistenza alla corrosione e di alta conducibilità, viene impiegato in una varietà di applicazioni tecnologiche avanzate, come nelle batterie, nei dispositivi elettronici e nelle tecnologie rinnovabili.
Principali usi e applicazioni dell’oro
Il rame è un metallo versatile che trova impiego in numerosi settori industriali grazie alle sue eccellenti proprietà fisiche e chimiche. Di seguito sono elencati i principali utilizzi del rame:
Oggetti più diffusi in rame:
- Fili e cavi elettrici
- Tubazioni e condutture
- Componenti elettronici e circuiti stampati
- Monete e medaglie
- Utensili e strumenti
- Componenti per la climatizzazione e refrigerazione
Settori che utilizzano il rame:
- Industria elettrica: Il rame è uno dei materiali più importanti per la produzione di cavi e fili elettrici, essendo il miglior conduttore elettrico tra i metalli comuni.
- Edilizia: Viene utilizzato per realizzare impianti idraulici, sistemi di riscaldamento e refrigerazione, oltre che come materiale per tetti e facciate.
- Industria elettronica: Il rame è impiegato in circuiti stampati e dispositivi elettronici grazie alla sua conduttività e resistenza.
- Energia rinnovabile: Il rame è un componente essenziale nella produzione di pannelli solari e turbine eoliche, contribuendo allo sviluppo delle tecnologie verdi.
- Trasporti: Viene usato nella fabbricazione di componenti per veicoli elettrici, ferrovie e aerei, grazie alla sua durabilità e leggerezza.
4 curiosità sul rame
- Il primo metallo lavorato
Il rame è stato il primo metallo conosciuto e lavorato dall’uomo, già 10.000 anni fa, ed è ancora oggi fondamentale per molteplici tecnologie.
- Per fare il bronzo serve il rame
Il rame è il principale componente del bronzo, una lega che ha segnato l’inizio della metallurgia moderna nell’Età del Bronzo.
- Resiste benissimo alla corrosione
Sebbene il rame possa ossidarsi, lo fa creando una patina protettiva di ossido di rame che lo protegge ulteriormente dalla corrosione.
- Come corten, alluminio, argento, e oro, il rame è un metallo che “vive”
Il rame è un materiale altamente riciclabile e, una volta estratto, può essere riutilizzato senza perdita delle sue proprietà fisiche, il che lo rende un elemento fondamentale nel processo di economia circolare.